Introducción
La primera pila eléctrica fue dada a por alessandro volta en 1800 mediante una carta que envió al presidente de la royal society.se trataba de una serie de pares de discos de cinc y de cobre ,separados unos de otros por trozos de cartón o de fieltro, que median unos 3 cm. de diámetro.El invento consistía una novedad absoluta y gozo de un éxito inmediato y muy merecido, ya que inicio la era eléctrica en que actualmente vivimos ,al permitir el estudio experimental preciso de la electricidad, superando las enormes limitaciones que presentaban para ello los generadores electroestáticos, que son los únicos que existían hasta el momento, Otra configuración también utilizada y descrita por volta para el aparato estaba formada por una serie de vasos con liquido ,en lo que se sumergían las tiras de los metales, conectando externamente un metal con otro.
Inmediatamente empezaron a hacerse por toda Europa y América innumerables pruebas con diversos líquidos, metales y configuraciones, tratando de mejorar las características del aparato original cosa que pocas veces se consiguió, pero que origino una infinidad de distintos tipos de pilas, de los cuales no ha quedado memoria mas que de los más notables.
¿Qué es una Pila eléctrica?
Una pila Eléctrica es un, mecanismo que convierte la energía química en eléctrica. Todas las pilas consisten en un electrolito (que puede ser líquido, sólido o en pasta), un electrodo positivo y un electrodo negativo. El electrolito es un conductor iónico; uno de los electrodos produce electrones y el otro electrodo los recibe. Al conectar los electrodos al aparato que hay que alimentar, llamado carga, se produce una corriente eléctrica.
Se encuentran también unas pilas solares, estas producen electricidad por un proceso de conversión fotoeléctricas pilas solares tienen una muy larga y se utilizan sobre todo en los aviones como fuente de electricidad para el equipo de a bordo.
¿Quién inventó las pilas?
El inventor de las pila se llama Alessandro volta o Conde Alessandro Giuseppe Antonio Anastasio Volta, físico y pionero en los estudios de la electricidad, nació en Como, Lombardía, Italia, el 18 de febrero de 1745, en el seno de una familia de nobles. Desde muy temprano se interesó en la física y a pesar del deseo de su familia de que estudiara una carrera jurídica, él se las ingenió para estudiar ciencias. En 1780 Luigi Galvani, científico y profesor de anatomía de la Universidad de Bolonia, en Italia, descubrió que al conectar dos metales diferentes en el muslo de una rana, se generaba una pequeña corriente eléctrica que se podía medir. Cuando en 1791 se publicaron los resultados de sus experimentos para obtener "electricidad animal", Volta se propuso encontrar otras alternativas que le permitieran obtener electricidad sin utilizar tejido . A partir de 1794 comenzó a experimentar con diferentes tipos de metales en sustitución de los tejidos orgánicos y en 1800 descubrió que colocando dos metales diferentes, de forma separada, dentro de un vaso conteniendo salmuera (agua y sal), se generaba igualmente electricidad.Algo tan usual y cotidiano hoy día en nuestras vidas, a Volta le supuso casi diez años detrabajo.En el descubrimiento de la pila, este físico italiano se apoyó en las teorías de Galvani. Este invento era el primer generador eléctrico que producía un flujo constante de corriente.

Función:
linterna y con ello se cierra el circuito entre el entre el polo positivo (+) y el polo negativo (-). Posteriormente se produce una reacción química dentro de la pila y como consecuencia, una corriente eléctrica entre ambos polos. Esta corriente eléctrica es la que se utiliza para hacer funcionar nuestra linterna.Por ejemplo, si tenemos una linterna que utiliza una pila, ponemos ésta dentro de la
Tipos De Pilas:
Pilas Alcalinas: No pueden reciclarse pero deben ir a un vertedero especial.
Pilas de litio: Producen tres veces más energía que las pilas alcalinas.

Pilas de cinc-aire: Se las distingue por tener gran cantidad de agujeros diminutos en su superficie.

Pilas de dióxido de litio-sulfuro: Este tipo de pila ha sido extensivamente usado en los sistemas de energía de emergencia de muchos aviones entre otros usos.

Pilas botón alcalino de manganeso: Las mismas características que las estándar del mismo tipo.

Pilas de monofluoruro de litio-carbono: Estas han sido una de las pilas de litios más comercialmente exitosas, de larga , alta densidad energética.

Pilas Botón Pilas botón de mercurio: Son llamadas así, las pilas de tamaño reducido, de forma chata y redonda. Estas Son muy contaminantes y pueden reciclarse para recuperar el mercurio.

Pilas botón de litio y dióxido de manganeso: Tienen de 2 a 4 veces más potencia que las alcalinas de manganeso.

Pilas de Níquel-Cadmio: Son pilas recargables. Son muy dañinas para el medio ambiente.

Pilas de óxido mercúrico: son las más tóxicas, contienen un 30 % aprox. de mercurio.

Pilas de óxido de plata: Son de tamaño pequeño, usualmente de tipo botón. Contienen 1 % de mercurio aproximadamente por lo que tienen efectos tóxicos sobre el ambiente.

Pilas Solares
Las pilas solares producen electricidad por un proceso de conversión fotoeléctrica. La fuente de electricidad es una sustancia semiconductora fotosensible, como un cristal de silicio al que se le han añadido impurezas. Cuando la luz incide contra el cristal, los electrones se liberan de la superficie de éste y se dirigen a la superficie opuesta. Allí se recogen como corriente eléctrica.
Las pilas solares tienen una vida muy larga y se utilizan sobre todo en los aviones, como fuente de electricidad para el equipo de a bordo.
PILA VOLTAICA
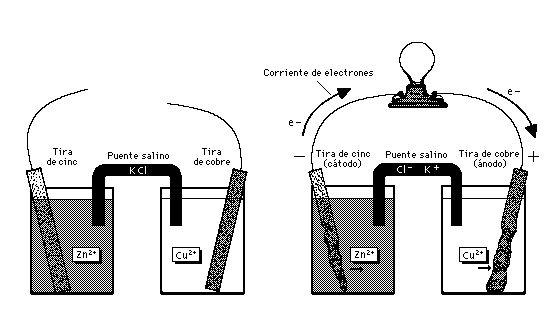
Una pila voltaica aprovecha la electricidad de una reacción química espontánea para encender una bombilla (foco). Las tiras de cinc y cobre, dentro de disoluciones de ácido sulfúrico diluido y sulfato de cobre respectivamente, actúan como electrodos. El puente salino (en este caso cloruro de potasio) permite a los electrones fluir entre las cubetas sin que se mezclen las disoluciones. Cuando el circuito entre los dos sistemas se completa (como se muestra a la derecha), la reacción genera una corriente eléctrica. Obsérvese que el metal de la tira de cinc se consume (oxidación) y la tira desaparece. La tira de cobre crece al reaccionar los electrones con la disolución de sulfato de cobre para producir metal adicional (reducción). Si se sustituye la bombilla por una batería la reacción se invertirá, creando una célulaelectrolítica.

 PILA CASERA O PILA DE DANIELL
Se necesita un frasco de cristal de boca ancha, un trozo de tubería de cobre que esté limpia, una tira de zinc o un sacapuntas metálico, dos cables eléctricos, un vaso de vinagre, un LED (diodo emisor de luz), que es como una bombilla muy pequeñita, parecida a las que iluminan algunos árboles de navidad, un reloj despertador o cualquier otro aparato que funcione con pilas.
A continuación se prepara el experimento:
PILA CASERA O PILA DE DANIELL
Se necesita un frasco de cristal de boca ancha, un trozo de tubería de cobre que esté limpia, una tira de zinc o un sacapuntas metálico, dos cables eléctricos, un vaso de vinagre, un LED (diodo emisor de luz), que es como una bombilla muy pequeñita, parecida a las que iluminan algunos árboles de navidad, un reloj despertador o cualquier otro aparato que funcione con pilas.
A continuación se prepara el experimento:
• Se llena el frasco de cristal con vinagre.
• Con un extremo de uno de los cables, se conecta el sacapuntas o tira de zinc y con un extremo del otro cable, se conecta la tubería de cobre. Se introducen ambos elementos en el frasco con vinagre.
• Los extremos libres de los dos cables se conectan bien a cada Terminal del LED o bien a los dos polos de la porta pilas del aparato. Conectar la polaridad, en el caso del reloj, de forma correcta. El polo positivo con la tubería de cobre y el negativo al sacapuntas o tira de zinc.
• ¿Qué ocurre con el LED?
Explicación: Las pilas tienen dos electrodos que suelen ser dos metales (en nuestro caso la tira de zinc o el magnesio del sacapuntas y el cobre de la tubería) y un electrolito, que es la sustancia que permite conducir la corriente eléctrica (en nuestro caso es el vinagre). La pila que estamos fabricando tiene una intensidad de corriente muy baja por lo que sólo podemos hacer funcionar algo que requiera unapotencia muy pequeña, como es el caso del LED.

• Se llena el frasco de cristal con vinagre.
• Con un extremo de uno de los cables, se conecta el sacapuntas o tira de zinc y con un extremo del otro cable, se conecta la tubería de cobre. Se introducen ambos elementos en el frasco con vinagre.
• Los extremos libres de los dos cables se conectan bien a cada Terminal del LED o bien a los dos polos de la porta pilas del aparato. Conectar la polaridad, en el caso del reloj, de forma correcta. El polo positivo con la tubería de cobre y el negativo al sacapuntas o tira de zinc.
• ¿Qué ocurre con el LED?
Explicación: Las pilas tienen dos electrodos que suelen ser dos metales (en nuestro caso la tira de zinc o el magnesio del sacapuntas y el cobre de la tubería) y un electrolito, que es la sustancia que permite conducir la corriente eléctrica (en nuestro caso es el vinagre). La pila que estamos fabricando tiene una intensidad de corriente muy baja por lo que sólo podemos hacer funcionar algo que requiera unapotencia muy pequeña, como es el caso del LED.
¿De qué están hechas las pilas?
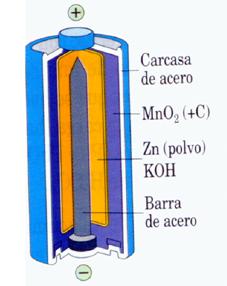
Las pilas normales están hechas de bióxido de magnesio y glicerina con esto se hace una pasta que recubre una barra de carbón, de retorta, que constituye uno de los electrodos y estos elementos se introduce en una caja cilíndrica de cinc, siendo esta el, polo negativo, y el carbón, central es el polo positivo y sola se cargan, al producirse la acción química entre el

Zinc/Carbono: son las pilas llamadas comunes o especiales para linterna, contienen muy poco Mercurio, menos del 0,01%. Esta compuesta por Carbono, Zinc, Dióxido de Manganeso y Cloruro de Amoníaco. Puede contaminar 3.000 litros de agua por unidad.
Alcalinas (Manganeso): son mas recientes que las anteriores. Su principio activo es un compuesto alcalino (Hidróxido Potasio). Su duración es 6 veces mayor que las Zinc/Carbono. Esta compuesta por Dióxido de Manganeso, Hidróxido de Potasio, pasta de Zinc amalgamada con Mercurio (total 1%), Carbón o Grafito. Una sola pila alcalina puede contaminar 175.000 litros de agua (mas de lo que puede consumir un hombre en toda su vida).
Mercurio: Fue la primer pila que se construyo del tipo micropila o botón. Exteriormente se construyen de acero y consta de un electrodo de Oxido de Mercurio con polvo de Grafito, el electrolito esta compuesto de Hidróxido de Potasio embebido en un material esponjoso absorbente y pasta de Zinc disuelto en Mercurio. Contiene entre un 25 y un 30% de Mercurio. Esta micropila puede contaminar 600.000 litros de agua.
Níquel/Cadmio: Esta pila tiene la forma de la pila clásica o alcalina, pero tiene la ventaja que se puede recargar muchas veces. Esta constituida por Níquel laminado y Cadmio separado por nylon o polipropileno, todo arrollado en espiral. No contiene Mercurio. Sus residuos son peligrosos para el medio ambiente, principalmente por la presencia del Cadmio.
Consecuencias
El peligro que producen las pilas que se desechan es uno de los temas prioritarios en la agenda de los ecologistas.Ya que la pila es un elemento que contiene diferentes metales en su composición como mercurio, magnesio, níquel y cinc.
Cada tipo de pilas tiene al menos dos metales presentes, como metales puros y como óxidos.La exposición a estos químicos puede provocar cáncer.
El peligro de los metales es:
Cadmio: agente causante de enfermedades respiratorias y su presencia afecta a los sistemas nervioso y cardiovascular. Es además un posible compuesto cancerígeno. En la naturaleza se concentra en la vegetación y los crustáceos, entre otros.
Mercurio: se va acumulando en los órganos del cuerpo humano, actuando como agente inhibidor de la enzimática y también puede provocar malformaciones fetales. Además, es tóxico para las aves y fauna salvaje y es responsable de lesiones en las plantas.
Plomo: a medida que se va acumulando, puede provocar lesiones al sistema nervioso y genera posibles efectos adversos en las funciones digestivas, reproductivas y neurológicas.
El Cinc: Metal no está considerado como tóxico pero sí algunos de sus compuestos como el óxido y el sulfuro.Se observó que en la superficie del acero galvanizado se forman con el tiempo "bigotes de cinc" que pueden liberarse al ambiente provocando cortocircuitos y fallos en componentes electrónicos. El problema causado por estos bigotes se ha agudizado con el paso del tiempo por haberse construido las salas de ordenadores y equipos informáticos sobre suelos elevados para facilitar el cableado en las que era común el uso de acero galvanizado, tanto en la estructura portante como en la parte posterior de las baldosas.
¿Cómo podemos reciclar y reutilizar las Pilas?
- Las pilas convencionales son sometidas a un proceso mecánico con diferentes etapas de trituración bajo condiciones de refrigeración con nitrógeno. Las pilas trituradas se introducen en un destilador que se calienta hasta la temperatura adecuada para su posterior condensación.
- Las pilas botón son sometidas a un proceso de tratamiento para la recuperación de mercurio también mediante destilación.
- El proceso de reciclaje empieza por deshacernos de las pilas usadas usando los contenedores de recogida selectiva que existen. Si realizamos una recogida selectiva, las pilas usadas se llevan a una planta de reciclaje de pilas, donde el mercurio se separa de otros metales y el resto de materiales que constituyen las pilas usadas pueden ser recuperados.

CONCLUSIÓN
Para empezar el voltaje de las pilas, depende de la diferencia de potencial existente entre el ánodo y el cátodo y como las mayores diferencias de potencial que se pueden conseguir en una pila son 7,5 voltios, no tiene sentido hablar de una pila de 140 voltios. (Además, las pilas comerciales de mayor voltaje no llegan a 4 voltios; los 7,5 mencionados son teóricos, ya que para lograrlo habría que usar un ánodo de estroncio (Sr) y un cátodo de fluoruro de xenón (XeF) en un hipotético disolvente que no fuera atacado por dichos compuestos). Sin embargo, alguien podría argumentar que en el mercado hay pilas de 9 voltios (o incluso más), ¿dónde está el error? No hay ninguno. Las pilas de nueve voltios en realidad son 6 pilas normales de 1,5 voltios, conectadas en serie. Volviendo al símil de los recipientes de agua, si necesitamos que entre dos recipientes haya una distancia de 9 metros pero la mayor que podemos conseguir es de 1 metro y medio, solucionamos el problema colocando 6 recipientes a alturas consecutivas de un metro y medio. La distancia total (que será proporcional a la fuerza de caída), será de 9 metros, aunque en 6 etapas distintas.
En el cuerpo humano se produce numerosas reacciones electroquímicas, pero no es posible coordinarlas para lograr un funcionamiento similar al de una pila convencional donde se consigue un flujo de electrones por un cable conductor. Hay corrientes eléctricas en movimiento, por ejemplo en los nervios; pero las intensidades son bajísimas, ya que estos flujos se utilizan para transmitir señales, no energía. Y también se podría argumentar que estas señales se coordinan para producir energía, como es el caso de los músculos. Sin embargo, no se trata de energía eléctrica sino energía conformacional (energía química debida a un cambio en la posición de las moléculas). Para almacenar energía eléctrica deberíamos disponer de unas células especializadas, llamadas electrocitos. Este es el caso de las anguilas, torpedos o rayas eléctricas. Estos peces poseen un órgano especializado, formado por este tipo de células, las cuales son capaces de producir una descarga eléctrica sincronizada de más de 600 voltios (durante un corto instante de tiempo).

